Die normale Art, ein Reaktionsprofil zu zeichnen, besteht darin, eine Barriere zwischen Reaktanten und Produkten zu platzieren, wie in der Frage gezeigt. Als oberste Barriere gilt der Übergangszustand . Der Reaktionsweg ist als solcher normalerweise nicht gut definiert, da sich während einer Reaktion viele Bindungswinkel und -abstände ändern. Dennoch ist diese Idee eines Weges sehr nützlich, um zu verstehen, was passiert. Was das Bild zeigt, und auch die hübsche Animation, ist, dass sich die Reaktanten nähern, es eine Art Interaktion gibt und dann die Produkte gebildet werden. Das Bild (oder die Animation) sagt uns jedoch nicht, wie dies geschieht und welche wichtigen Faktoren der Vorstellungskraft überlassen bleiben.
Zunächst müssen die Reaktanten genügend Energie aufnehmen, um den Übergangszustand oben auf der Barriere zu erreichen. Die durchschnittliche Energie der Reaktanten wird normalerweise als Linie links in der Figur mit dem Wort Reaktanten dargestellt. Diese Energie ist normalerweise weit geringer als die Barrierehöhe (mit Ausnahme diffusionskontrollierter Reaktionen, siehe unten), und dies bedeutet, dass die Reaktanten meistens miteinander kollidieren, wenn keine Reaktion stattfindet. Es gibt einfach nicht genug Energie, um zu reagieren, unabhängig davon, ob die Reaktion endotherm oder exotherm ist oder nicht.
Da sich das Molekül nun in Lösung oder in der Gasphase bei einem angemessenen Druck von inertem Puffergas befindet, treten viele Kollisionen pro Sekunde zwischen Reaktanten und Lösungsmittel (oder Puffergas) auf. In Lösung treten Kollisionen bei auf eine Rate von mindestens $ 10 ^ {12} s ^ {- 1} $. Nur gelegentlich, vielleicht 1 in $ 10 ^ 9 $ Kollisionen, ist man energisch genug, um den Reaktanten genug Energie zu geben, um die Spitze der Barriere zu erreichen Übergangszustand Die Reaktion kann stattfinden, vorausgesetzt, die Reaktanten befinden sich in der richtigen Ausrichtung und es tritt schnell genug eine Kollision auf, um genügend Energie aus dem Übergangszustand zu entfernen und damit die Energie zu senken, was eine Reaktion unmöglich macht.
Obwohl die durchschnittliche kinetische Energie des Lösungsmittels $ 3RT / 2 $ pro Mol beträgt und klein ist < 4kJ / mol, gibt es eine Energieverteilung, die durch die Boltzmann-Verteilung gegeben ist. Die Wahrscheinlichkeit, eine Energie $ E $ zu haben, ist proportional zu $ exp (-E / (RT)) $ und ist daher sehr gering, wenn $ E $ beispielsweise 100 kJ / mol beträgt, und deshalb haben viele Reaktionen kleine Geschwindigkeitskonstanten und warum Es sind so viele Kollisionen erforderlich, bevor eine Reaktion auftreten kann.
Im Übergangszustand, da die Energie hier weit über dem Durchschnitt liegt, wird bei einer Kollision mit dem Lösungsmittel im Durchschnitt ein wenig Energie entfernt, anstatt sie zu addieren, und so wird das Produkt stabilisiert.
(Die hier gegebene Beschreibung ist ziemlich grob, detailliertere Überlegungen führen zu Kramers Modifikation der Übergangszustandstheorie, und dies beinhaltet die Berücksichtigung der "Reibung" an der Reaktionskoordinate, sowohl vom Lösungsmittel als auch von inneren Schwingungen in Die Reaktanten behindern oder unterstützen die Bewegung entlang der Reaktionskoordinate.)
Bei einigen Reaktionen ist die Reaktionsbarriere sehr klein, was bedeutet, dass sie nur geringfügig größer ist als die durchschnittliche Energie bei dieser Temperatur. In diesem Fall tritt eine Reaktion auf, sobald die Reaktanten miteinander kollidieren. Die Reaktionsgeschwindigkeit wird nun dadurch begrenzt, wie schnell die Reaktanten kollidieren können, und dies wird durch ihre Diffusionskonstanten bestimmt, die wiederum von der Lösungsviskosität abhängen. Dies sind diffusionskontrollierte Reaktionen. Im gleichen Lösungsmittel haben sie immer eine größere Geschwindigkeitskonstante als eine Reaktion mit einer größeren Barriere
Es ist wichtig zu wissen, dass der experimentelle Beweis für die Übergangszustände in der Tat sehr, sehr lückenhaft ist. In der schönen Animation können wir sehen, wie sich Bindungen dehnen und brechen usw., aber dies basiert möglicherweise auf Berechnungen, sicherlich auf chemischer Intuition und auf Indizien aus chemischen Experimenten, die jedoch keine zeitaufgelösten spektroskopischen sind. Der Grund dafür, dass ein Übergangszustand nicht erkannt werden kann, besteht darin, dass er höchstens ca. 10 ^ {- 13} $ und wahrscheinlich weniger dauert, und selbst bei Reaktionen, die mit einem Femtosekunden-Laserpuls begonnen wurden, war es nicht möglich, sie zu erkennen selbst bei photoinduzierten Reaktionen wie der trans-cis-Photoisomerisierung von Stilben (Diphenylethen), vermutlich weil ihre Konzentration gering ist.
Bei einfachen Reaktionen wie O + H $ _2 $ = H + OH, die in einem Molekularstrahl durchgeführt werden, waren viel größere Fortschritte möglich. Diese Reaktionen werden bei sehr niedrigem Gasdruck gemessen und ein Atomstrahl schneidet einen Molekülstrahl und die Produkte werden spektroskopisch und / oder auf ihre Energie und räumliche Verteilung analysiert.
Es ist möglich, eine potenzielle Energieoberfläche als eine Reihe von Konturen darzustellen, genau wie eine Karte, die Hügel und Täler zeigt. Obwohl die Oberfläche empirisch ist, wird sie unter Verwendung bekannter Schwingungspotentiale für die zweiatomigen Moleküle und des Heitler-London-Valenzbindungsansatzes berechnet. (Die Oberfläche wird nach London, Eyring, Polanyi und Sato LEPS genannt.)
1 zeigt die potentielle Energie, aufgetragen gegen die OH + H-Trennung (vom Zentrum von OH genommen) als Ordinate und die O + H $ _2 $ -Trennung als Abszisse. (Beachten Sie, dass bei der Berechnung davon ausgegangen wurde, dass die Kollision zwischen O + H $ _2 $ linear ist (nur am Ende) und dass H $ _2 $ -Rotationen nicht in die Einstellung der anfänglichen Kollisionsparameter einbezogen werden.) Der Übergangszustand befindet sich am Punkt ca. (0,12, 0,09) ), gelber Kreis. Dies ist der „Sattelpunkt“, an dem die Oberfläche entlang des Reaktionspfades eine konvexe Krümmung und eine dazu senkrechte konkave Krümmung aufweist. Die dunkelblaue Farbe zeigt die niedrigste Energie, das gelb / grüne Zwischenprodukt und das rote die höchste.
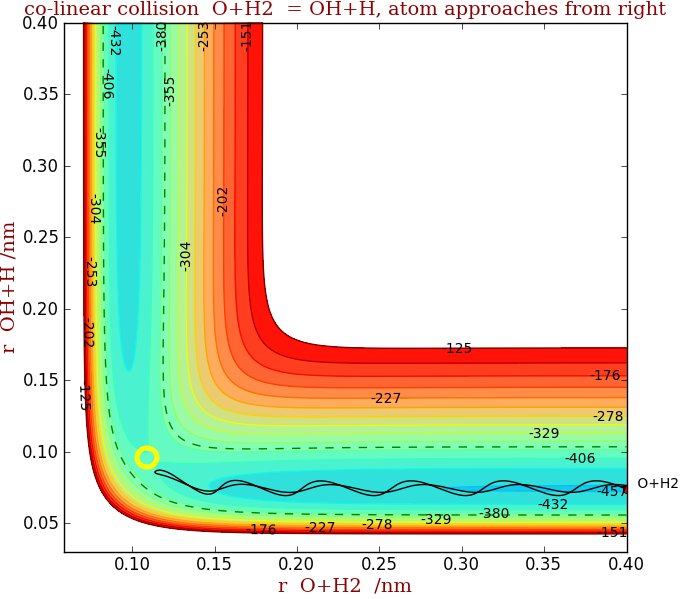
Die durchgezogene Linie zeigt eine Flugbahn eines Co- lineare Kollision zwischen O + H $ _2 $ und beginnt ganz rechts in der Abbildung. Die Konturen der gestrichelten Linie beschreiben die Gesamtenergie, die Kollisionsenergie (kinetische Energie) plus die anfängliche Schwingungsenergie in H $ _2 $. Die Schwingungen im rechten Tal zeigen die Schwingung von H $ _2 $, wenn es sich dem O-Atom nähert. In Abb. 1 sind die Schwingungen so groß, dass sich das Molekül aufgrund seiner Anfangsgeschwindigkeit und Schwingungsenergie an der falschen Stelle auf dem Potential befindet, um den Übergangszustand zu überqueren und so das Tal hinunter zurückzukehren. Es ist keine Reaktion aufgetreten.
In der zweiten Abbildung wird der Übergangszustand gekreuzt, obwohl die Gesamtenergie dieselbe ist, da Vibrationen die Reaktanten an der richtigen Stelle auf der Oberfläche platzieren. Vibrationen im Produkt OH sind im vertikalen Tal zu sehen. Daher ist der wichtige Punkt, dass nicht nur die Gesamtenergie, sondern auch die Orientierung und die Schwingungsenergie wichtig sind, um eine Reaktion auszulösen.

Durch Beobachtung von Rotations- und Vibrationsenergien in Produkten und Reaktanten bei Reaktionen wie diesen kann die potenzielle Energieoberfläche ermittelt werden. Die Verbindung mit (thermischen) Geschwindigkeitskonstanten, wie sie in Experimenten mit normaler chemischer Kinetik (nichtmolekularer Strahl) gemessen wurden, wird hergestellt, indem die Anzahl der Übergangszustandskreuzungen bei einer gegebenen Energie berechnet und dann über Kollisions- und kinetische Energien gemittelt wird