Sie müssen die Orbitale mischen, sie mit den Elektronen füllen und prüfen, ob Sie eine Nettobindung haben.
ZB: H + H zwei 1s-Orbitale mischen sich zu Sigma und Sigma *. Insgesamt zwei Elektronen, beide besetzen das Sigma-Orbital, zwei mehr Elektronen in der Bindung als antibindende Orbitale, die Verbindung ist stabil.
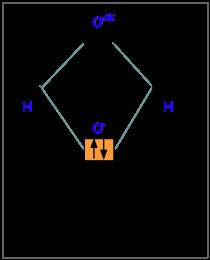
ZB: He + He; gleiche Mischung wie oben. Vier Elektronen, zwei im Sigma, zwei im Sigma *. Da es so viele Bindungselektronen wie antibindend gibt, gibt es keine Nettobindung. He2 ist nicht möglich.
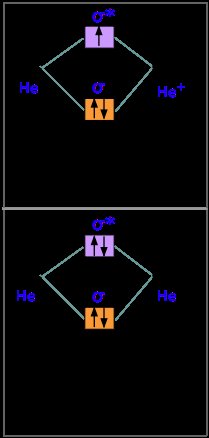
ZB: He + H; gleiche Mischung wie oben. Drei Elektronen, zwei in Sigma, eines in Sigma *. Ein Elektron mehr beim Binden als beim Antibinden. He-H bildet eine sehr schwache Bindung. Bitte beachten Sie, dass das Diagramm für He2 + ist, aber das He-H sehr ähnlich ist.
ZB: Li + H; Li hat 1s + 2s, während H 1s hat. Diese Mischung bildet ein Sigma-Orbital aus H1s + Li2s, ein Sigma * -Orbital und H1s-Li2s und ein nicht bindendes Orbital aus Li1s (energiearmer als das Sigma). Vier Gesamtelektronen. Nichtbindendes Sigma ist besetzt, und dann ist das Sigma-Orbital besetzt. Nettoeffekt: Li-H bildet eine stabile Bindung.

Möglicherweise haben Sie bemerkt, dass die ersten drei Diagramme eine identische Struktur hatten, auch wenn ihre Energieniveaus unterschiedlich waren. Dies ist eine Eigenschaft der quantenmechanischen Symmetrie, und zur Lösung des Problems müssen nur einige Diagrammtypen bekannt sein und die Elektronen ausgefüllt werden. Betrachten Sie die zweite Reihe. Das Diagramm lautet wie folgt:
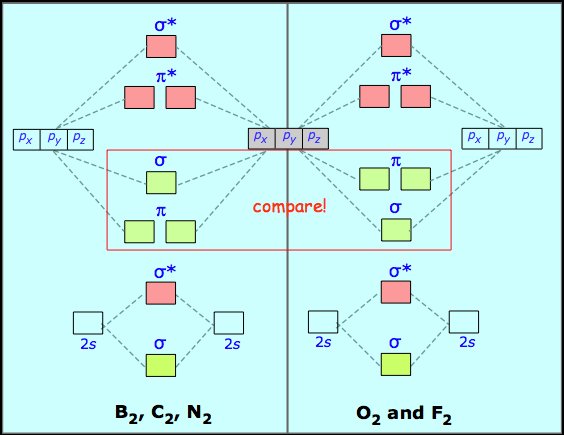
Sie zählen einfach die Valenzelektronen und füllen das Diagramm aus. Dann subtrahieren Sie die Anzahl der Bindungsorbitalelektronen von der Antibindung, und wenn Sie mehr haben, haben Sie eine Bindung.
Einige Webseiten sind sehr gut für weitere Erklärungen:
Quelle der Diagramme: http://www.chem1.com/acad/webtext/chembond/cb08.html
und http: //www.meta-synthesis .com / webbook / 39_diatomics / diatomics.html