Wenn diese Verbindung eine nukleophile Substitution eingehen kann, kann sie nur über SN1-Mode erfolgen, als umgekehrter Seitenangriff im Anti-Bindungs-$ \ ce {C. -Br} $ Orbital wird vom anderen Brückenkopf blockiert.
Der häufig angegebene Grund, warum Brückenkohlenstoffkationen nicht stabil sind, ist die Dehnung. Die Belastung selbst ist ein Konzept, das schwer zu verstehen ist und häufiger davon abhängt, was Sie als Referenzsystem auswählen. Für den einzigen qualitativen Zweck ist das Kation stärker belastet als ein nicht verengtes tertiäres Kation.
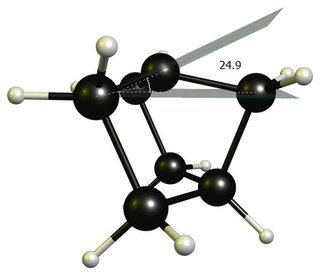
Ein weiterer häufig angegebener Grund ist, dass die Carbokation keine trigonale planare Struktur annehmen kann. Während dies technisch wahr ist, ist die Abweichung von einer idealen trigonalen Umgebung ziemlich gering; es ist nur etwa 25 °. (DF-BP86 / def2-SVP)
Ich glaube, der Grund für diese Instabilität ist etwas anders. In $ \ ce {C + (CH3) 3} $ können sich die Wasserstoffkohlenstoffbindungen sauber mit dem leeren p-Orbital des zentralen Kohlenstoffs ausrichten. Daher kann die Elektronendichte in dieses Orbital übertragen werden oder aus einem anderen Blickwinkel kann die positive Ladung in die benachbarten Bindungen delokalisiert werden.
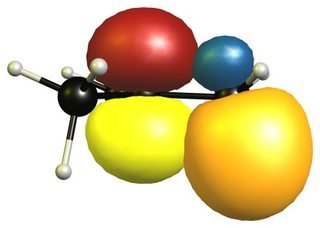
Das Obige ist Nur eine Beispielkonfiguration, berechnet bei DF-BP86 / def2-SVP. Es ist nicht die niedrigste Struktur, sondern eine, die ausgewählt wurde, um die Überlappung in der Hyperkonjugation zu zeigen. Da das Molekül überhaupt nicht starr ist und sich die Methylgruppen drehen, ist der stabilisierende Effekt die meiste Zeit vorhanden. In dieser Konformation ist dies am einfachsten zu erkennen.
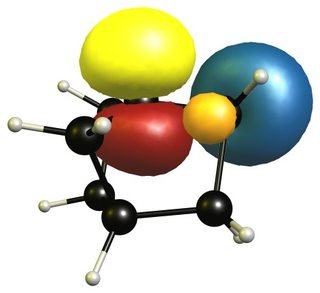
Dieser stabilisierende Effekt ist für den Kohlenstoff nicht vorhanden Wasserstoffbrücken in der Nähe des Brückenkopfes. Diese Wasserstoffatome weisen tatsächlich vom kationischen Zentrum weg, daher ist eine Überlappung überhaupt nicht möglich. Daher kann die Ladung durch diese Anleihen nicht stabilisiert werden.
Es gibt jedoch eine kleine stabilisierende Konfiguration zwischen den Kohlenstoff-Kohlenstoff-Bindungen und dem nicht besetzten Orbital, und dies ist der Grund, warum Brückenkopf-Carbokationen mit größerer Ringstruktur stabiler werden.
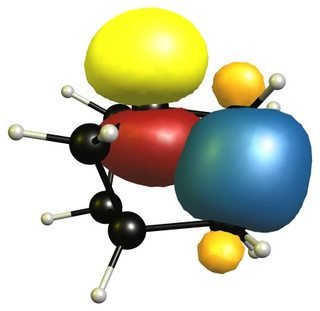
Wie immer gibt es ein paar verschiedene Punkte im Spiel, die helfen, bestimmte Positionen zu stabilisieren oder dies nicht mehr zu tun.
Also mit der richtigen Motivation ein S N sub > 1 Reaktion ist möglicherweise möglich.
Farbcode
Besetzte Orbitale werden in Orange und Blau angezeigt, während virtuelle Orbitale in Rot und Gelb angezeigt werden. Die Phasen werden zufällig ausgewählt.