Finden von Minima: eine allgemeine Ansicht
Wenn Sie die Energie minimieren, suchen Sie (mit numerischen Methoden) nach dem Minimum an potentieller Energie. Sie sind am Minimum, wenn die Ableitung (Jacobian) gleich Null ist. Es gibt jedoch einige instabile Stellen, die ebenfalls eine Ableitung von Null haben, nämlich Sattelpunkte und Maxima (Kreisoberseite). Wir sind hinter dem Minimum (am Ende eines Kreises).
Denken Sie an ein Pendel. Es hat zwei Stellen, an denen die Ableitung Null ist ... wenn sie ganz oben und ganz unten ist, aber nur wenn sie ganz unten ist, ist sie stabil. Wenn der Hessische Wert (zweite Ableitung) eindeutig positiv ist, befinden Sie sich am "Ende der Pendelschwingung" und auf einem Minimum. Das Pendel der Ableitung ist Null, aber dies ist ein Maximum.
Es gibt auch das Problem, dass es in Energielandschaften oft wie eine Achterbahn aussieht ... Auf Wunsch eines Kommentators ein besseres Bild (aus Wikipedia, Quelle in der Bildbeschreibung)
![AimNature [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)]](https://chemie.narkive.de/sop6LpBz/definieren-definieren-sie-die-stabilitat-und-energie-einer-verbindung:i.1.full)
Wir müssen nicht nur das Minimum finden, das eine Ableitung von Null hat, sondern das niedrigste aller vorhandenen Minima. Dies ist ein sehr schwieriges Problem, da numerische Löser aufhören, sobald die Ableitung Null ist. Sie wissen nicht, dass es andere Mindestanforderungen gibt. Es gibt Methoden, um dies zu umgehen, aber es ist ein sehr aktives Forschungsgebiet, und es wartet ein riesiger Preis darauf, wer ein globales Minimum garantieren kann.
Ein Gedanke an Energie
Was ist diese Energie, die wir minimieren? Wir minimieren die Energie im Vergleich zu einem Referenzpunkt. Alles bezieht sich immer auf einen Bezugspunkt.
Ich bin kein Chemiker und kenne nicht viel Quantenmechanik, aber ich werde versuchen, eine chemische Antwort zu geben ... Dies ist mein Eindruck davon, was in dem Szenario gemacht wird, nach dem Sie fragen. Ich führe Minimierungen für freie Energie durch, aber das hängt damit zusammen, aber nicht ganz das, wonach Sie suchen. In der Quantenmechanik ist der Bezugspunkt, wenn alle Kerne und Valenzelektronen unendlich voneinander entfernt sind. Ein weiterer gemeinsamer Bezugspunkt in Chemie, Physik und Technik ist das ideale Gas, bei dem alle Moleküle unendlich voneinander entfernt sind, aber Atome (und Elektronen) immer noch miteinander verbunden sind.
Bei gegebenem Bezugspunkt was wir als "Null" -Energie definieren, würden wir für jeden Konformer die Energie berechnen, um alle kovalenten Bindungen im Molekül zu bilden, dh die Energie berechnen, um die Valenzelektronen und Kerne aus unendlich weit auseinander zu ziehen und Platzieren Sie sie genau in der gewünschten Geometrie. Tun Sie dies für viele Geometrien. Diejenige, die die niedrigste Energie benötigt hat, um sich zu formen, ist die stabilste von denen, die Sie versucht haben (es kann andere geben, die Sie nicht versucht haben! Sie befinden sich möglicherweise immer noch in der falschen Schleife der Achterbahn). Es erfordert unterschiedlich viel Arbeit, um zwei Kerne in unterschiedlichen Abständen voneinander zu trennen usw. In der Praxis erledigen QM-Programme all dies für uns, und sie werden ziemlich schnell, aber es kann immer noch sehr lange dauern. Die Berechnung ist schwierig.
Bindungsenergien
In der Molekularmechanik werden Bindungsenergien im Allgemeinen unter Verwendung der harmonischen Federnäherung (Hakengesetz) berechnet. Das folgende Bild zeigt jedoch das berechnete QM Energien.
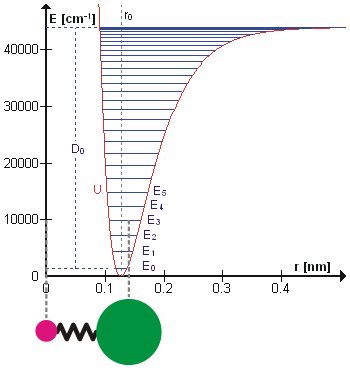
Winkelnergien
Hier ist ein Bild von der Website der Simulationssoftware Espresso zeigt, dass die zum Biegen eines Winkels erforderliche Energie durch eine quadratische Funktion
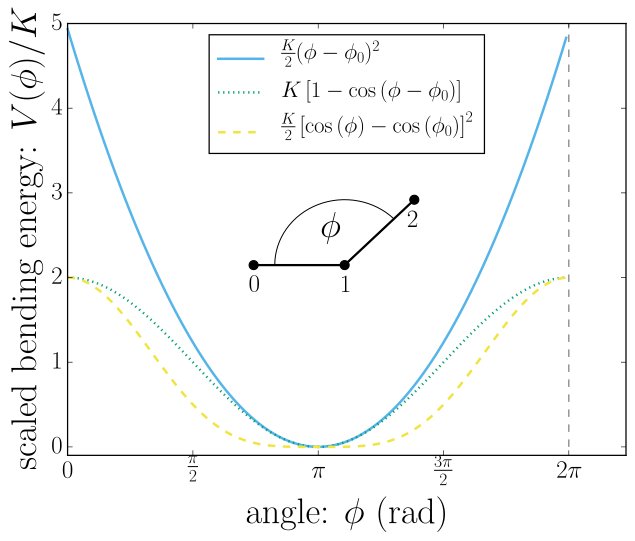
Torsionsenergien
eng angenähert wird
Torsionsenergien sind komplizierter als die Bindungs- und Winkelpotentialenergien, da ein Torsionswinkel um 360 Grad gedreht werden kann und wieder dort sein muss, wo er begonnen hat. Hier ist die Energie für verschiedene Konformere, wenn die Geometrie des Torsionswinkels gedreht wird. Aufgrund der unterschiedlichen Geometrien sind die Kerne und Elektronen unterschiedlich weit voneinander entfernt, und es erfordert einen unterschiedlichen Arbeitsaufwand (Energie), um sie von unendlich weit auseinander zu jeder dieser Geometrien zu bewegen. Das Bild stammt von hier.
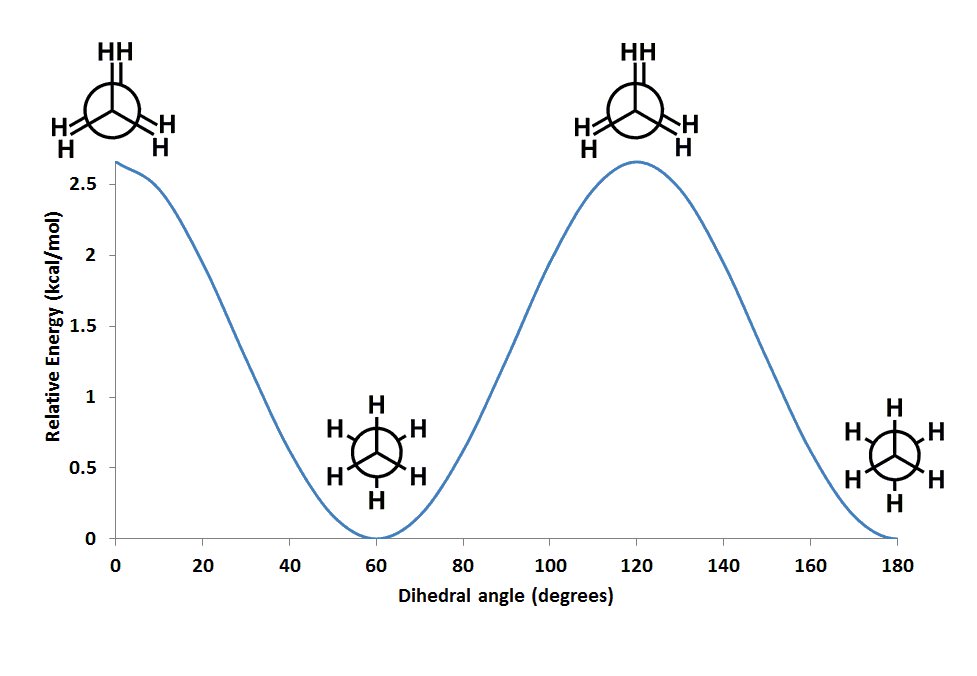
Kraftfelder
In der molekularen Mechanik Wir verwenden Funktionen (Kraftfelder genannt), um die oben genannten potenziellen Energiebeiträge zu approximieren. Hier ist ein allgemeiner Satz der verwendeten Gleichungen. Sie können das Minimum an Energie ermitteln, indem Sie die Bindungslängen / -winkel / Torsionsparameter für ein einzelnes Molekül ändern und nach jeder Änderung die Energie berechnen. Die Geometrie mit der niedrigsten Energie ist am stabilsten, da Moleküle wie Menschen immer den Weg des geringsten Widerstands einschlagen. Ich habe die Gleichungen als Bild von hier
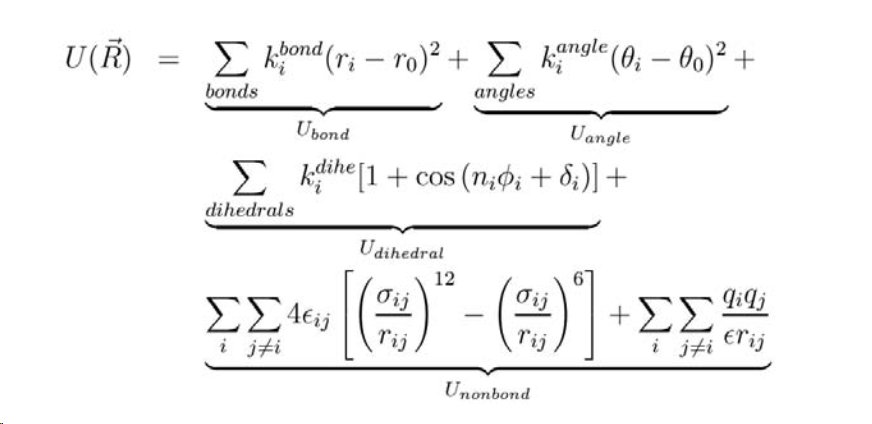
kopiert