Ich werde argumentieren, dass der Abstand zwischen Molekülen aus sehr fundamentalen Gründen im Allgemeinen mit der Temperatur zunimmt, obwohl normales Eis (I h sub>) und flüssiges Wasser eine Ausnahme bilden. Bei niedrigen Temperaturen minimieren Substanzen ihre Energie, was normalerweise zu geordneten kristallinen Anordnungen führt. Bei hohen Temperaturen maximieren Substanzen ihre Entropie. Das heißt, bei hohen Temperaturen ist alles so zufällig und durcheinander wie möglich.
Angenommen, Sie haben einen leeren Raum, gibt es mehr Möglichkeiten, zwei Moleküle weit voneinander entfernt zu platzieren, als zwei Molekulare nahe beieinander zu platzieren . Sie können dies in der folgenden Abbildung sehen. Es gibt mehr Möglichkeiten, ein zweites Molekül in der blauen Kugelschale in großer Entfernung vom zentralen Wassermolekül zu platzieren, als Wassermoleküle in der orangefarbenen Kugelschale in kurzer Entfernung vom zentralen Wassermolekül. Tatsächlich nimmt die Anzahl der Möglichkeiten zum Platzieren des zweiten Wassermoleküls mit dem Volumen der Kugelschale zu, dh wie 4 & pgr; R 2, wobei R der Abstand zwischen den Molekülen ist. Der Zustand, in dem zwei Wassermoleküle einen großen Abstand zwischen sich haben, hat eine größere Entropie als der Zustand, in dem sie einen kurzen Abstand zwischen sich haben.
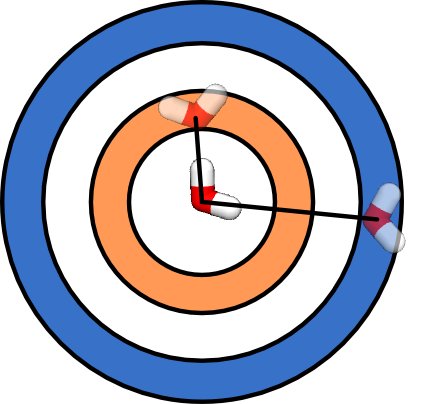
Einfach aufgrund der Geometrie neigen Moleküle bei hohen Temperaturen dazu, weit voneinander entfernt zu sein. Wasser kocht bei hohen Temperaturen, einfach weil es mehr Möglichkeiten gibt, Wassermoleküle in der gesamten Küche zu verteilen, als alle Wassermoleküle in den Topf zu geben. Die meisten Substanzen werden bei ausreichend hohen Temperaturen zu Gasen, wenn genügend Leerraum vorhanden ist. Die meisten Substanzen dehnen sich mit steigender Temperatur aus.
Das Hinzufügen eines Abstands zwischen Molekülen ist nicht die einzige Möglichkeit, die Entropie zu erhöhen, was die Ausnahme des schmelzenden Eises darstellt. Die Entropie kann auch zunehmen, indem die Anordnung der Moleküle und ihre Orientierungen ungeordneter werden. Flüssiges Wasser hat mehr Entropie als Eis, nicht weil die Moleküle weiter voneinander entfernt sind, sondern weil sie zufälliger angeordnet und ausgerichtet sind.