Warum kann Fluor nicht das zentrale Atom in Halogen-Verbindungen sein?
Zunächst einmal kann Fluor im "Zentrum der Dinge" stehen. Beispiele wären die stark wasserstoffgebundene Flusssäure

und das sehr relevante Beispiel des Trifluoridanions
$$ \ ce {[FFF] ^ -} $$
Das Beispiel für Trifluoridanionen ist kritisch, da es zeigt, dass Fluor hyperkoordiniert (hypervalent) sein kann. Natürlich haben wir in diesem letzten Beispiel das Fluor dazu gebracht, die mittlere Position einzunehmen, sodass Ihre Frage (leicht verändert) bleibt, warum Fluor nicht häufiger eine zentrale Position einnimmt.
In Um diese Frage zu beantworten, müssen zwei allgemeine Fälle berücksichtigt werden:
- Die anionische Situation $ \ ce {[XFX] ^ -} $ vs. $ \ ce {[XXF] ^ -} $
- Die kationische Situation $ \ ce {[XFX] ^ +} $ vs. $ \ ce {[XXF] ^ +} $
wobei X Cl, Br oder I ist.
Im Fall des Anions deuten Lewis-Punktstrukturen auf eine negative Ladung am Zentralatom hin.
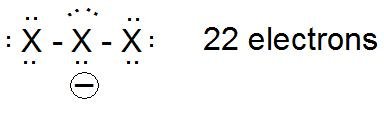
Eine rechnerische Analyse der Elektronenverteilung im Triiodidanion (siehe S. 156) legt jedoch nahe, dass das Zentralatom positiv geladen ist (+0,27 Elektronen), während die terminalen Atome negativ geladen sind (-0,63 Elektronen an jedem terminalen Atom). Unter der Annahme, dass der gleiche allgemeine Trend auf gemischte Trihalogenidanionen anwendbar wäre, würden wir im Fall von $ \ ce {[XFX] ^ -} $ eine positive Ladung auf ein hochelektronegatives Fluoratom anstatt auf das größere, polarisierbarere (z besser in der Lage, eine positive Ladung zu tragen) Brom-, Chlor- oder Iodatom
Im Fall des Kations kommen ähnliche Argumente ins Spiel. Wiederum deuten Berechnungen für eine Vielzahl von Trihalogenidkationen (gemischt und homogen) auf eine erhebliche positive Ladung des Zentralatoms hin (diesmal in Übereinstimmung mit Lewis-Dot-Strukturen). Die gleichen Argumente, die oben gemacht wurden, würden hier funktionieren, um Strukturen mit einem zentralen Fluoratom zu destabilisieren. Diese Analyse ergab auch extrem lange (weniger stabilisierende) Bindungen, wenn Fluor (oder das elektronegativste der 3 Atome) die zentrale Position einnahm.
Argumente, die nicht erklären Das seltene Auftreten von Fluor an einer zentralen Position in Halogen-Verbindungen umfasst:
- das Fehlen von "d-Orbitalen" ; Wie andere kommentiert haben, ist dies ein altes, ungültiges Argument. Die Existenz von $ \ ce {F3 ^ -} $ zeigt, dass Fluor zu einer hyperkoordinierten Bindung fähig ist, ohne dass eine Beteiligung des d-Orbitals erforderlich ist.
- ineffiziente 2p-3p-Überlappung ; $ \ ce {FCl} $ hat eine höhere Bindungsstärke und eine geringere Bildungswärme als $ \ ce {Cl2} $