Dies ist in der Tat eine verwirrende Frage. Stabilität im Vergleich zu was? Betrachten wir ihre Leichtigkeit der Bildung aus einem neutralen Molekül, dh die Bindungsdissoziationsenergie (BDE oder $ DH ^ \ circ $ span>) einer Kohlenstoff-Wasserstoff-Bindung von Propen? Toluol und Isobutan? [Ethan wird ignoriert.] Oder vergleichen wir die drei Radikale vom selben Ausgangspunkt aus, ihre Bestandteile im Standardzustand. In diesem Fall müssen wir ihre Bildungswärmen berücksichtigen?
Für das Homolytikum Dissoziation eines Moleküls $ \ ce {R - H} $ span> zu zwei Radikalen $ \ ce {R ^. + H ^.} $ Span>, die Summe der Bildungswärme $ \ Delta_ \ mathrm f H ^ \ circ $ span> von $ \ ce {RH} $ span> und der $ \ ce {RH} $ span> Bindungsdissoziationsenergie (BDE) entsprechen der Summe der Wärme der Bildung der beiden Radikale $ \ ce {R ^.} $ span> und $ \ ce {H ^.} $ . Dies folgt aus dem Hessschen Gesetz:
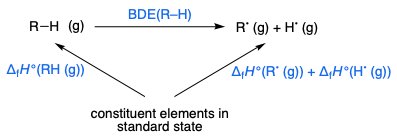
Gasphasen-Bildungswärmen sind auf der NIST-Website verfügbar. und die BDEs sind hier verfügbar. Vergleich von $ \ ce {CH} $ span> BDEs (in $ \ pu {kcal / mol} $ span>) gibt die Reihenfolge der Stabilität als Allyl an ( $ + 88,8 $ span>) <-Benzyl ( $ + 89,7 $ span>) < t -butyl ( $ + 96,5 $ span>).
Wenn andererseits die Bildungswärme der drei Radikale relativ zum Standardzustand berechnet wird, lautet die Reihenfolge t -Butyl ( $ + 12,4 $ span>) < allyl ( $ + 41,6 $ span>) < benzyl ( $ + 49,7 $ span >). [Der Wert von $ \ pu {+52 kcal / mol} $ span> für $ \ Delta_ \ mathrm f H ^ \ circ (\ ce {H ^. (g)}) $ span> ist die Hälfte des BDE des Wasserstoffmoleküls.]
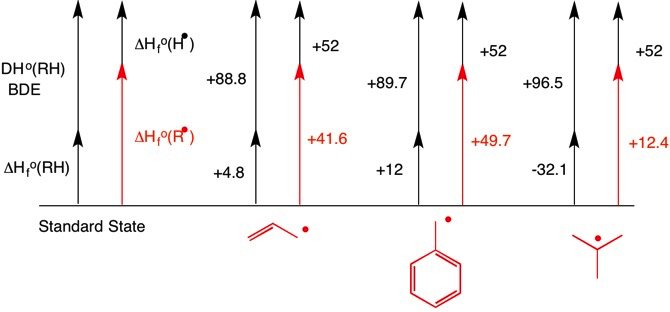
$$ \ begin {align} & & \ Delta_ \ mathrm f H ^ \ circ (\ ce {R ^.}) & = \ Delta_ \ mathrm f H ^ \ circ ( \ ce {RH}) + \ text {BDE} (\ ce {RH}) - \ Delta_ \ mathrm f H ^ \ circ (\ ce {H ^.}) \\\ ce {R} & = \ text { Allyl:} & \ Delta_ \ mathrm f H ^ \ circ (\ ce {R ^.}) & = \ pu {4,8 kcal / mol} + \ pu {88,8 kcal / mol} - \ pu {52 kcal / mol} \\ & & & = \ color {red} {\ pu {+41,6 kcal / mol}} \\\ ce {R} & = \ text {benzyl:} & \ Delta_ \ mathrm f H \ {R ^.}) & = \ pu {12 kcal / mol} + \ pu {89,7 kcal / mol} - \ pu {52 kcal / mol} \\ & & & = \ color {red} {\ pu {+ 49,7 kcal / mol}} \\\ ce {R} & = \ textit {t} \ text {-butyl:} & \ Delta_ \ mathrm f H. ^ \ circ (\ ce {R ^.}) & = \ pu {-32,1 kcal / mol} + \ pu {96,5 kcal / mol} - \ pu {52 kcal / mol} \\ & & & = \ color { rot} {\ pu {+12,4 kcal / mol}} \\\ end {align} $$ span>