Es gibt bereits genügend Antworten auf Ihre Frage. Aber ich möchte auch meine Meinung teilen;). Vorbemerkung: Orbital bedeutet nicht Elektron, was Sie sich vorstellen können, ist genau dort, wo es wahrscheinlich gefunden wird, was im Grunde genommen eine ist Orbital.
Erstens können Sie ein Orbital nicht visualisieren, da es 3 unabhängige Variablen hat (nur im Fall eines Wasserstoff-ähnlichen Atoms. Für andere Atome mit 2 oder mehr Elektronen ist es größer als 3) Visualisiere es du brauchst eine 4-D-Vision , was sicherlich nicht möglich ist. Sie können jedoch einen Teil des Anteils visualisieren, z. B. 99%, indem Sie Farbtöne verwenden. Wo es wahrscheinlicher ist, dass es gefunden wird, können Sie es dunkler machen oder wo es wahrscheinlich nicht gefunden wird, lassen Sie es weiß.

1s Orbital
 2s Orbital
2s Orbital
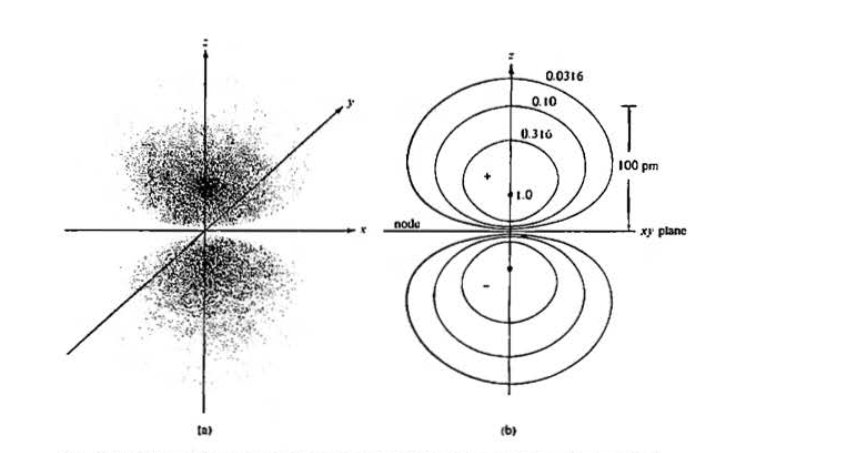
 2p Orbital
2p Orbital
Es gibt aber auch einen anderen Weg es sieht nicht gut aus, so wie wir einige aufeinanderfolgende Volumina einschließen, um die Wahrscheinlichkeitsdichte für das Auffinden von Elektronen im jeweiligen Volumen zu beschreiben (so etwas wie Schichten) (Das rechte Bild ist das Konturdiagramm , das linke ist es das gleiche wie oben).
Wenn Sie sich auf einer Linie bewegen, befinden Sie sich in einem Bereich, in dem die Wahrscheinlichkeitsdichte gleich ist. Diese werden als Isoflächen bezeichnet. Diese können sehr ausgefallen sein, schön zu visualisieren. Hier sind einige Iso-Grenzflächen einiger Orbitale. Achtung: Jedes dieser Bilder zeigt keine Bilder von Orbitalen, sondern nur Grenzflächen. (In vielen Büchern werden diese Bilder ohne irreführende Klarstellung auf Bilder des Orbitals verwiesen.)