Stickstoff befindet sich in der zweiten Reihe ohne $ d $ -Orbital in der Valenzschale. Es folgt der Oktettregel und kann nicht mehr als 8 Elektronen haben.
Es gibt Ausnahmen von der Oktettregel. Weniger als 8 Elektronen zu haben ist weniger bevorzugt, aber immer noch möglich und wird üblicherweise in freien Radikalen und Kationen gesehen. Andererseits ist es für Atome der zweiten Periode äußerst ungünstig, mehr als 8 Elektronen zu haben. Solche elektronischen Strukturen können in extrem instabilen Spezies oder angeregten Zuständen wie dem CH5-Radikal gefunden werden.
Zum Vergleich: Atome der ersten Schale gehorchen der Duettregel, während Atome in der 3. Schale und darüber hinaus 18- gehorchen können. Elektronenregel, 12-Elektronen-Regel oder 8-Elektronen-Regel. Die 18-Elektronen-Regel und die 12-Elektronen-Regel sind jedoch viel weniger streng als die 8-Elektronen-Regel, und Verstöße sind an der Tagesordnung.
Gemäß der Valenzbindungstheorie ist die elektronische Struktur von Ein Molekül ist eine Kombination aller möglichen Resonanzstrukturen, die Sie aufschreiben können, einschließlich Strukturen mit allen möglichen formalen Ladungen und seltsamen Elektronenzahlen. Ihre Beiträge sind jedoch nicht gerade. Einige von ihnen sind günstiger als andere.
Für HNO3 würde das Stickstoffatom 1 Doppelbindung und 2 Einfachbindungen bilden, um die Oktettregel zu erfüllen. Allein basierend auf der Oktettregel gibt es 3 mögliche Resonanzstrukturen, die günstig sind.
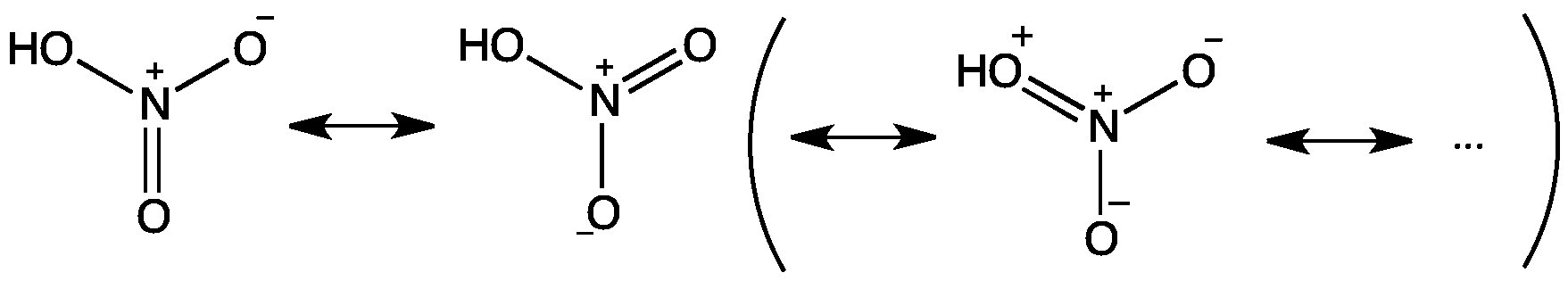
Die ersten beiden Resonanzstrukturen sind jedoch erheblich günstiger als die dritte, weil sie haben geringere formelle Gebühren. Daher schreiben wir normalerweise nur die beiden dominanten Strukturen. Die Bindung zwischen OH und N liegt nahe an einer normalen Einfachbindung. Die anderen beiden NO-Bindungen haben eine Bindungsordnung nahe 1,5.
Es ist auch üblich, eine Mischung von Resonanzstrukturen als Hybridform p zu schreiben >
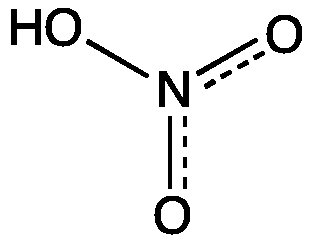
Beachten Sie, dass diese Darstellung keine einzelne Lewis-Struktur ist, sondern eine bequeme Möglichkeit, viele Resonanzstrukturen in derselben Figur darzustellen. Es gibt keine Informationen über die genaue Bindungsreihenfolge oder die formalen Ladungen einzelner Atome. Die gepunkteten Linien zeigen an, dass in einigen Strukturen, in denen diese Bindung eine Einfachbindung und in anderen eine Doppelbindung ist, die Reihenfolge irgendwo zwischen 1 und 2 liegt