Interessante Frage!
Ein paar Dinge zuerst:
Wenn das Eis schmilzt, kühlt es das Wasser um es herum ab.
Technisch gesehen schmilzt der Eiswürfel , weil das Wasser abkühlt. Das mag zunächst lächerlich klingen, aber Sie müssen die Tatsache berücksichtigen, dass das Eis schmilzt, weil es "Wärme" (Energie) aus seiner Umgebung gezogen hat. Die "Umgebung" ist die Luft und das Wasser, die sie umgeben (aber das Wasser ist wichtiger, da es die Wärmeenergie besser leitet).
Angesichts der Tatsache, dass kaltes Wasser dichter als heißes Wasser ist, würde ich es tun Angenommen, das kalte Wasser würde auf den Boden sinken ... aber es würde sich beim Absinken erwärmen und die Dichte verringern.
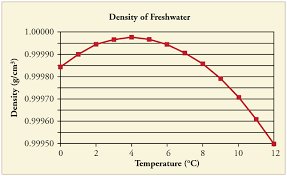
Sie haben Recht, kaltes Wasser ist dichter als heißes Wasser. Es ist jedoch hilfreich zu beachten, dass es nicht zu kalt sein sollte. Wenn die Wassertemperatur auf 4 ° C abfällt, nimmt die Wasserdichte allmählich zu. Wenn jedoch die Temperatur unter 4 ° C fällt, beginnt die Dichte des Wassers tatsächlich zu sinken, und Wasser in diesem Bereich "schwimmt" leicht über Wasser im Raumtemperaturbereich.
Währenddessen schmilzt das Eis immer noch und gibt seine Kälte an das umgebende Wasser ab.
Eis ist nicht ' Wenn Sie nicht von seiner "Kälte" abgeben, nimmt es die "Wärme" (Wärmeenergie) des Wassers auf.
Zurück zu Ihrer Frage.
Wie Max in seiner Antwort erwähnt, haben Sie besonders gut angegeben, mit welchen physikalischen Parametern wir es zu tun haben. Die wirklich wichtigen sind die Eistemperatur, die Wassertemperatur (zum Zeitpunkt des Einlegens des Eises) und die Menge des verwendeten Eises (zumindest in Bezug auf das Wasser).
Angenommen, Sie trinken Wasser (ursprünglich bei Raumtemperatur) aus einem 250-ml-Styropor- oder Plastikbecher, haben zwei (normal große) Eiswürfel verwendet und eine Minute nach dem Eintauchen mit dem Trinken des Wassers begonnen Bei den Eiswürfeln sollte das Wasser oben kälter sein als unten.
Betrachten Sie winzige, imaginäre Schichten / Regionen / Päckchen Wasser in der Tasse (denken Sie darüber nach) Begriffe von Wasser "Paketen" anstelle von Wassermolekülen sind leichter zu verstehen). Stellen Sie sich den Becher auch als drei (grob abgegrenzte) Bereiche vor: oben, in der Mitte und unten.
Wasserpakete unmittelbar neben den Eiswürfeln befinden sich im thermischen Gleichgewicht mit den äußersten Bereichen des Eises. Diese Pakete gewinnen jedoch bald etwas Wärmeenergie von anderen Wasserpaketen, die an sie angrenzen. Wenn die Temperatur dieser Pakete langsam von null Grad auf über 4 ° C steigt, sinken sie und neue Pakete besetzen Orte neben dem Eis. Der Zyklus wiederholt sich so lange, wie das Eis vorhanden ist.
Wenn diese Eispakete sinken, gewinnen sie mehr Wärmeenergie aus den Wasserpaketen, mit denen sie auf ihrem Weg nach unten in Kontakt kommen. Dies führt zusammen mit den viskosen Effekten von Wasser zu einem leichten "Aufwärmen" der sinkenden Pakete.
Jetzt, da sie sich etwas erwärmen, neigen sie dazu, wieder aufzusteigen . Zurück oben werden sie abgekühlt und sinken wieder. Dieser Vorgang wiederholt sich so lange, wie das Eis im Wasser bleibt.
Wenn Sie einen Schritt zurücktreten, werden Sie feststellen, dass die Mitte des Bechers kalt und der Boden des Bechers kalt sein sollte kälter und die Oberseite der Tasse ist die kälteste .
Selbst wenn die Eiswürfel Ihre Lippen nicht wirklich berühren, werden Sie es tun Finden Sie, dass das Wasser oben kälter ist, als wenn Sie Wasser von unten durch einen Strohhalm heraussaugen.