Es tut mir leid, wenn dies eine allgemeine Frage ist, aber ich versuche, ein einfaches Experiment zu planen. Ich frage mich, ob es eine etwas einfache Möglichkeit gibt, $ \ ce {CO2} $ span> kontinuierlich zu messen. Ich weiß bereits, dass der anfängliche Kohlendioxidgehalt bei $ \ pu {2.2g} $ span> aus der Forschung liegt, aber ich weiß nicht, wie dieses Ergebnis erreicht wird. P. >
Messen Sie die Massenänderung der verbleibenden Flüssigkeit über die Zeit. Obwohl auch etwas Wasser verdunstet, können Sie dies kontrollieren, indem Sie die Luftfeuchtigkeit nahe 100% halten.
Wenn Sie genau sein müssen, sammeln Sie die entgaste $ \ ce {CO2} $ span> in einer Flüssig-Stickstoff-Kühlfalle. Überprüfen Sie die Masse des Kondensats, die der von der Soda verlorenen entsprechen sollte. Überprüfen Sie die Reinheit, um wirklich pingelig zu sein.
Messen Sie die Konzentration in einem festgelegten Luftvolumen.
Am einfachsten ist es, sie in einen versiegelten undurchlässigen Beutel oder Karton zu legen und die CO2-Konzentration über die Zeit zu messen. Heimwerker verwenden so etwas wie den CO2-Sensor MG-811 oder einen einfachen nichtdispersiven optischen Sensor und verbinden ihn über einen Analog-Digital-Wandler-Chip (ADC) mit einem Raspberry Pi oder Arduino. Für (ein wenig) mehr dazu siehe diese Antwort auf Warum sind CO2-Sensoren so teuer, wenn CO-Sensoren nicht sind?
. ..CO2-Sensoren sind entweder chemische Festelektrolytzellen wie der MG-811 oder neuere Versionen (siehe diese Frage) oder sie basieren auf nichtdispersiven Infrarotlichtsensoren (NDIRs) bei optischer Absorption einer bestimmten Wellenlänge von Infrarotlicht unter Verwendung eines heißen Filaments oder einer anderen Lichtquelle zur Erzeugung von IR und eines schmalen mehrschichtigen optischen Filters zur Auswahl einer der starken Absorptionslinien von CO2. Je mehr CO2 vorhanden ist, desto geringer ist die Verringerung der Lichtdurchlässigkeit im Strahlengang des Sensors.
Sie würden das Gesamtvolumen der eingeschlossenen Luft schätzen und mit dem Anteil multiplizieren, der CO2 ist ( zu jedem Zeitpunkt), um die akkumulierte Menge an CO2 zu erhalten, die von der Flüssigkeit freigesetzt wird.
Messen Sie die in einem CO2-Wäscher gesammelte Menge
Aufbauend auf der von @DrMoishe Pippi vorgeschlagenen Technik Obwohl ich keine Präzision garantieren kann, könnten Sie versuchen, neben einer Kühlfalle noch etwas anderes zur Absorption von CO2 zu verwenden.
Ich schlage vor, dass Sie einen Kohlendioxidwäscher in Betracht ziehen.
Lithiumhydroxid ist jedoch möglicherweise nicht für den Heimgebrauch geeignet, da es sehr gefährlich ist, es zu berühren oder auf andere Weise zu berühren! Sie sollten dies daher unter Aufsicht tun.
Von PubChem; Lithiumhydroxid (Verbindung)
Lithiumhydroxid-Lösung erscheint als klare bis wasserweiße Flüssigkeit, die einen stechenden Geruch haben kann. Kontakt kann zu schweren Reizungen der Haut, der Augen und der Schleimhäute führen. Es kann durch Verschlucken, Einatmen und Absorption der Haut toxisch sein. Es wird zur Herstellung anderer Chemikalien verwendet.
Regeneratives Kohlendioxid-Entfernungssystem
Die regenerative Kohlendioxid-Entfernung Das System (RCRS) des Space-Shuttle-Orbiters verwendete ein Zwei-Bett-System, das eine kontinuierliche Entfernung von Kohlendioxid ohne Verbrauchsprodukte ermöglichte. Regenerierbare Systeme ermöglichten einer Shuttle-Mission einen längeren Aufenthalt im Weltraum, ohne dass die Sorptionsmittelkanister nachgefüllt werden mussten. Ältere Systeme auf Lithiumhydroxid (LiOH) -Basis, die nicht regenerierbar sind, wurden durch regenerierbare Systeme auf Metalloxidbasis ersetzt. Ein auf Metalloxid basierendes System bestand hauptsächlich aus einem Metalloxid-Sorptionsmittelbehälter und einer Regeneratoranordnung. Es funktionierte, indem Kohlendioxid unter Verwendung eines Sorptionsmaterials entfernt und dann das Sorptionsmaterial regeneriert wurde. Der Metalloxid-Sorptionsmittelbehälter wurde regeneriert, indem 10 Stunden lang Luft mit ungefähr 204 ° C (400 ° F) und einer Standarddurchflussrate von 0,0035 m3 / s (7,5 cu ft / min) durch ihn gepumpt wurde. blockquote>
Wie genau dies zu tun ist, erfordert einige Eingaben eines tatsächlichen Chemikers. Dies lässt sich am besten als neue Frage stellen: "Wie wird LiOH (Pellets oder Pulver) von der Stange als hausgemachter CO2-Wäscher verwendet?" Zum Beispiel.
Wenn Sie den offenen Behälter in einen größeren Behälter (versiegelte, undurchlässige Plastiktüte oder Schachtel) mit etwas anderem stellen, das CO2 absorbiert und bei Raumtemperatur daran festhält, können Sie es vor und abwiegen nach als Untergrenze zumindest für das durch die Flüssigkeit verlorene CO2.
Wenn Sie jemals den Film Apollo 13 gesehen haben oder die Geschichte des CO2-Gaswäscherkanisters kennen ( 1, 2) Sie erinnern sich vielleicht, dass es das ausgeatmete CO2 des Astronauten aus der Kabinenluft entfernt und es in den darin enthaltenen festen LiOH-Pellets gehalten hat.
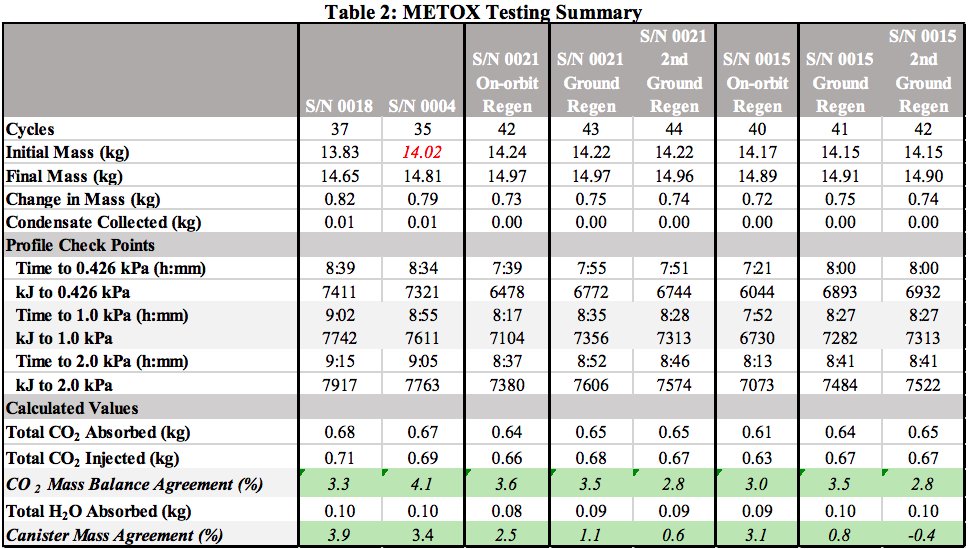
Da es kompakt sein musste, aber ein großes Luftvolumen schrubben musste, verwendete das Raumschiff einen Ventilator, um Luft durch den Wäscher zu zirkulieren. In Ihrem Fall kann jedoch möglicherweise Lithiumhydroxid oder ein anderes Material wie Silberoxid verwendet werden (siehe diese Antwort und EMU METOX Performance Testing).
Hier sind einige Daten aus diesem Bericht. Sie können sehen, dass die ~ 14 kg Silberoxid ungefähr 0,8 kg CO2 enthalten könnten.
Geschichte aus der NASA Erstellen eines Apollo 13 LiOH-Kanisteradapters:
Für eine direkte Messung des Gehalts von $ \ ce {CO2} $ span> kann Infrarotspektroskopie (IR) verwendet werden. Infrarotstrahlung kann von Molekülen absorbiert werden, wodurch sie vibrieren. Die genaue Frequenz der absorbierten Strahlung ist häufig charakteristisch für bestimmte Bindungen oder funktionelle Gruppen.
Insbesondere der grundlegende antisymmetrische Streckmodus von $ \ ce {CO2} $ span> in wässriger Lösung (speziell das Kohlenstoff-12-Isotopolog $ \ ce {^ {12} CO2 (aq)} $ span>, nicht Kohlensäure $ \ ce {H2CO3} $ span>) wird durch Photonen der Wellenlänge $ \ mathrm {4268 \ nm} $ angeregt span> (wird aus historischen Gründen häufiger als $ \ mathrm {2342.9 \ cm ^ {- 1}} $ span> Wellenzahlen angegeben). Dieser Schwingungsmodus ist aus folgenden Gründen nützlich:
- Der Absorptionspeak ist ziemlich scharf mit einer "Breite" (FWHM) von nur $ \ mathrm {9 \ cm ^ {- 1}} $ span>
- Das molare Absorptionsvermögen ist bei $ \ mathrm {1,5 \ times 10 ^ 6 \ stark cm ^ 2 \ mol ^ {- 1}} $ span>
- Die Absorptionsintensität variiert linear mit der Konzentration
- Nur wenige andere Substanzen haben eine starke Absorption in derselben Region
Insgesamt machen diese Eigenschaften den Peak für analytische Messungen geeignet. Dies wurde in Vib besprochen. Spect., 1992, 4 (1), 105-108. Obwohl der Artikel die Möglichkeit nicht untersuchte, ist es wahrscheinlich, dass die Technik für die Verwendung in Limonaden angepasst werden könnte. Messungen können möglicherweise direkt in ungeöffneten Flaschen durchgeführt werden. Darüber hinaus gibt es ähnliche Vorteile für die Messung von gasförmigem $ \ ce {CO2} $ span>, sodass eine unabhängige Messung des Raums über der Flüssigkeit mit demselben Instrument durchgeführt werden kann Die Ergebnisse wurden auf zusätzliche Genauigkeit überprüft.
Dies wäre für einen Hobbyisten, der Küchenchemie betreibt, nicht sehr einfach (obwohl handgehaltene / kompakte / tragbare IR-Spektrometer existieren und nicht sehr teuer sind), aber eine solche Studie wäre für die meisten chemischen Labors sehr gut erreichbar.
Möglicherweise möchten Sie eine $ \ ce {CO2} $ span> -Ionenselektive Elektrode verwenden, z. B. PS-3517 von PASCO:
Diese ISE-Sonde (Carbon Dioxide Ion Selective Electrode) ist eine Gassensorelektrode, die eine schnelle, einfache, wirtschaftliche und genaue Messung von gelöstem CO2 in wässrigen Lösungen ermöglicht.
Der Vorteil gegenüber anderen Methoden besteht darin, dass Sie die Konzentration in situ messen und sich daher nicht mit der Erfassung von $ \ ce {CO2} $ span befassen müssen > quantitativ (Gewichtung kleiner Mengen), wie $ \ ce {CO2} $ span> von anderen Gasen (z. B. Wasser, das aus dem Gas entfernt oder verhindert werden muss) unterschieden werden kann Kondensation in der $ \ ce {CO2} $ span> -Falle), über komplizierte intermittierende Abtastungen und darüber, wie sich die Erfassungsrate auf Ihre Messung auswirken könnte.
Es sollte mit Coca-Cola funktionieren:
eingestellt werdenpH-Bereich: Sam ples und Standards müssen auf unter pH 4,00
Eine ganz andere Methode, die angesichts des hohen anfänglichen Karbonatisierungsgrades in Coca-Cola (141 mM nach meiner Schätzung basierend auf diesem Beitrag) gut funktionieren sollte, ist $ \ ce {^ {13} C} $ span> -NMR. Siehe zum Beispiel Referenz 1. Spektren flüssiger Lösungen haben eine hohe Auflösung und eindimensionale Daten können kontinuierlich in einer Zeitspanne von wenigen Minuten pro Spektrum erfasst werden.
Beachten Sie, dass die Spektren möglicherweise bei natürlicher $ \ ce {^ {13} C} $ span> -Häufigkeit (ca. 1%) oder mit Spikes (angereichert) aufgenommen werden ) mit $ \ ce {^ {13} C} $ span>, was natürlich (viel) teurer sein wird. Auf der anderen Seite können Sie möglicherweise den freigegebenen $ \ ce {^ {13} C} $ span> mit einer der in einer der anderen vorgeschlagenen Methoden zur Wiederverwendung erfassen Antworten.
Referenzen
- Qi Yang, Mark Bown, Abdelselam Ali, Dave Winkler, Graeme Puxty und Moetaz Attalla. Eine Kohlenstoff-13-NMR-Studie zur Absorption und Desorption von Kohlendioxid mit wässrigen Aminlösungen. Energy Procedia 1 (2009) 955–962 ol>